Chapter 13
1. Berapakah pH larutan NaOH 0,1 M pada temperatur 25 oC!
(a)12 (d)11
(b)13 (e)15
(c)14
Jawaban:(b)13
NH4+(aq) + NO2- (aq) → N2(g) + 2H2O(l)
Diberikan oleh nilai 5 k[NH4+ ][NO2- ]. Pada 258oC, nilai konstan adalah 3,0 x 10-4/M s. Hitung tingkat reaksi pada suhu ini jika [NH4+ ] 5 0,26 M dan [NO2-] 5 0,080 M......(...x 10
(a)5.2 (d)7.2
(b)4.2 (e)5.5
(c)6.2
Jawaban:(c)6.2

(a) Reaksi berlangsung dua arah pada waktu bersamaan
(b) Reaksi berlangsung dalam dua arah dalam laju reaksi yang sama
(c) Jumlah mol zat yang ada pada keadaan setimbang selalu sama
(d) Masing-masing zat yang bereaksi sudah habis
(e) Jumlah zat yang terbentuk dalam reaksi sama dengan pereaksi
2. Agar pada reaksi kesetimbangan:
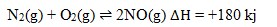
Jumlah gas NO yang dihasilkan maksimal, maka tindakan yang diperlukan adalah…
(a) Menaikan tekanan
(b) Menurunkan takanan
(c) Mengecilkan volum
(d) Menaikan suhu
(e) Memperbesar volume
Jawaban:(b) Menurunkan takanan
Menurut Azas Le Chatelier, jika sistem dalam kesetimbangan terjadi kenaikan suhu, maka akan terjadi pergeseran kesetimbangan kearah reaksi yang menyerap kalor (Apabila koefisien sama antara produk dan reaksi maka volume dan tekanan tidak mempengaruhi reaksi.
Reaksi diatas termasuk reaksi endoterm jadi jika dinaikkan suhu maka kesetimbangan akan bergeser kearah reaksi endoterm atau bergeser kearah kanan (NO), jika reaksi bergeser kerah kanan maka nilai Kc akan semakin besar.
(a) Meningkatkan [H+] bila dimasukkan kedalam H2O
(b) Menurunkan [H+] bila dimaasukkan kedalam H2O
(c) Meningkatkan [OH–] bila dimasukkan kedalam H2O
(d) Menerima 1 H+ dari pasangan reaksinya
(e) Memberi 1 H+ dari pasangan reaksinya
Jawaban:(e) Memberi 1 H+ dari pasangan reaksinya
Teori asam Brosnted-Lowry:
Asam: zat yang memberikan 1 H+ pada pasangan reaksinya.
Basa: zat yang menerima 1 H+ dari pasangan reaksinya.
10-14)…….
(a) 5 X 10-10
(b) 5 X 10-18
(c) 0,2 X 10-10
(d) 0,2 X 10-8
(e) 2 X 10-10
Jawaban:(a) 5 X 10-10
Dalam larutan dengan pelarut air, berlaku :
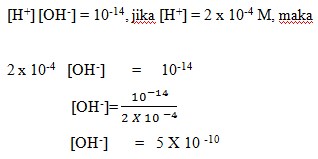
(a) 3,3 x 10-17
(b) 4 x 10-16
(c) 2,7 x 10-15
(d) 4 x 10-12
(e) 3,3 x 10-5
Jawaban : (C) 2,7 x 10-15
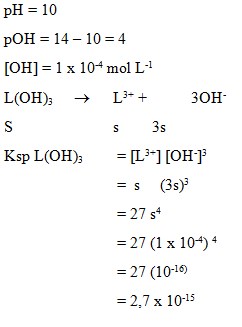
(a) CH3COOH/CHOOH
(b) CHOO–/CH3COO–
(c) HCl/Cl–
(d) NH3/NH4OH
(e) HOCl/OCl–
Jawaban : (e)HOCl/OCl–
Penyangga itu ada dua jenis yaitu penyangga asam (komponennya : asam lemah + basa konjugasinya) dan penyangga basa (komponennya : basa lemah + asam konjugasinya).
CH3COOH/CHOOH → Asam lemah/asam lemah
CHOO–/CH3COO– → Basa konjugasi/basa konjugasi
HCl/Cl– →Asam kuat/ion
NH3/NH4OH→Basa lemah/basa lemah
HOCl/OCl– →Asam lemah/basa konjugasi
Hubungan antara konstanta keseimbangan, K,dan emf standar diberikan oleh Persamaan(19,5) teks: Esel = (0,0257 V / )ln . Jadi, mengetahui n (mol elektron ditransfer) dan konstanta keseimbangan, kita dapat menentukan Esel D .
Persamaan yang berhubungan dengan K dan emf sel standar adalah:
Kami
melihat dalam reaksi bahwa Mg pergi ke Mg2+ dan Zn2+ pergi ke Zn. Oleh karena itu, dua
mol elektron ditransfer selama reaksi redoks. Ganti
konstanta keseimbangan dan mol e - ditransfer( transferred(n = 2) ke dalam persamaan di atas untuk menghitung E°.







Tidak ada komentar:
Posting Komentar