Chapter 19
1.
(2)
Lithium-9 seharusnya kurang stabil.
Rasio neutron-to-proton terlalu tinggi. Untuk atom kecil, rasio n/p ratio akan mendekati
1:1.
(4) Natrium-25 kurang stabil. Rasio neutron-to-proton
mungkin terlalu tinggi.
(6) Scandium-48 kurang stabil karena jumlah proton dan
neutron yang ganjil. Kita tidak akan mengira
berharap
kalsium-48 stabil meskipun memiliki sejumlah proton ajaib. Rasio n/p terlalu tinggi
2.Untuk setiap pasang elemen yang tercantum, tentukanlah mana yang lebih stabil isotop: (1) Co (2) Ni (3) F (4) Se (5) Ag (6) Cd.
(a)2,5,6 (d)4,5,6
(b)1,3,6 (e)1,2,3
(c)2,4,6
Jawaban:(c)2,4,6
Nikel, selenium, dan kadmium memiliki isotop yang lebih stabil. Karna Ketiganya memiliki nomor atom yang genap(lihat Tabel 23.2 teks).(a) Menimbulkan hujan asam
(b) Pencemaran udara di dalam rumah
(c) Menipisnya Ozon
(d) Pencemaran udara di lingkungan sekitar perumahan
Jawaban : (c) Menipisnya Ozon

Jawaban:(e)7.12
Reaksi reduksinya yaitu :Al3+(aq) + 3e- → Al(s)
Pertama, kita dapat menghitung jumlah yang dibutuhkan untuk menyetor 664 g Al
N2(g) + O2(g) →2NO (g)
Mengingat bahwa ¢G° untuk reaksi pada 298 K is173,4 kJ / mol, hitunglah pembentukan energi
gratis standar NO......(kJ/mol)
(a)96.7 (d)65.7
(b)66.7 (e)95.7
(c)86.7
Jawaban:(c)86.7
Chapter 23(b) V (e) Zn
(c) Cr
Jawaban: (e)Zn
Karena tidak adanya elektron tunggal di orbital d pada (konfigurasi) Zn sehingga tidak dimungkinkan adanya perpindahan elektron ke orbital lain yang dapat memancarkan energi pada panjang gelombang tertentu yang menunjukkan warna tertentu.
Cd2+(aq) + 2e- ↔ Cd(s) E0=-0.40 volt
Zn2+(aq) + 2e- ↔ Zn(s) E0=-0.76 volt
Ni2+(aq) + 2e- ↔ Ni(s) E0= -0.23 volt
Urutan daya pengoksidasi (oksidator) mulai dari yang lemah ke yang kuat adalah…
(a) Cd>Zn>Ni
(b) Zn>Ni>Cd
(c) Cd>Ni>Zn
(d) Zn>Cd>Ni
(e) Ni>Cd>Zn
Jawaban: (e)Ni>Cd>Zn
2. Sel elektrokimia yang melibatkan sumber energi listrik adalah...
(a) Elektrokimia
(b) Elektromagnetik
(c) Sel Volta
(d) Sel Elektrolisis
(e) Sel Galvani
jawaban : (d)Sel Elektrolisis
Chapter 25
1.Pada elektrolisis larutan CuSO4 dengan elektrode Pt, dialirkan arus listrik 2 Ampere selama 965 detik (Ar Cu=63,5) maka banyaknya logam tembaga yang dihasilkan … mg
(a) 317,5 (d) 1.270
(b) 635,0 (e) 1.905
(c) 952,5
Jawaban : (b)635,0
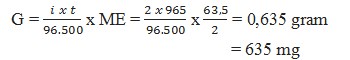
2.Bahan yang digunakan sebagai elektrode pada sel aki (accu) adalah …
(a) Pt dan C
(b) Zn dan C
(c) Pb dan Pbo2
(d) Zn dan Cu
(e) Cu dan PbO2
Jawaban : (c)Pb dan PbO2
Aki merupakan sel yang banyak kita jumpai karena banyak digunakan pada sepeda motor maupun mobil. Aki temasuk sel sekunder, karena selain menghasilkan arus listrik, aki juga dapat diisi arus listrik kembali.
Secara sederhana Sesuai prinsip pada sel Volta, aki merupakan sel yang terdiri dari elektrode Pb sebagai anode dan PbO2 sebagai katode dengan elektrolit H2SO4.





Tidak ada komentar:
Posting Komentar